Vol. 26, núm. 1 enero-febrero 2025
El naufragio de los pensamientos
Ivan Alquisiras-Burgos, Hilda Angélica Martínez-Becerril, Arturo Hernandez Cruz y Penélope Aguilera CitaResumen
Un funcionamiento cerebral adecuado requiere de un suministro constante de sustratos energéticos, principalmente de glucosa, los cuales son transportados en la sangre circulando por las arterias que recorren todo el organismo. En el cerebro, estas arterias controlan rigurosamente el transporte de todas las moléculas que llegan al cerebro, y están constituidas por el endotelio vascular cerebral, que forma la barrera hematoencefálica. En un infarto cerebral, el flujo sanguíneo se ve interrumpido y el suministro de los compuestos vitales disminuye, lo que provoca una alteración en las funciones cerebrales; entonces el individuo sufrirá fallas en el movimiento, el lenguaje o en alguna de las funciones controlada en la región afectada del cerebro. Además, mientras no se recupere el flujo sanguíneo se activarán muchos procesos de daño, entre éstos destaca uno muy peligroso que puede causar la muerte: el incremento en la cantidad de agua contenida en el cerebro, conocido como edema. Su formación puede provocar una catástrofe como la vivida por los pasajeros del Titanic, quienes nunca sospecharon que el gran coloso pudiera ser vulnerable y naufragar. En este artículo, relataremos la forma en que un infarto cerebral puede provocar la acumulación de agua en este tejido.
Palabras clave: ictus, infarto cerebral, edema cerebral.
The shipwreck of thoughts
Abstract
Adequate brain function requires a constant supply of energy substrates, primarily glucose, which is transported through the blood circulating in the arteries throughout the body. In the brain, these arteries strictly regulate the transport of molecules that reach it and are composed of the cerebral vascular endothelium, which forms the blood-brain barrier. During a stroke, cerebral blood flow is interrupted, reducing the supply of energy substrates and causing alterations in brain function. As a result, the individual may experience impairments in movement, language, or other functions controlled by the affected brain region. Furthermore, if blood flow is not restored, numerous damaging processes are activated. Among these, the increase in brain water content, known as edema, is particularly serious. Its formation can cause a catastrophe like the one experienced by the Titanic passengers who never imagined that the great colossus could be vulnerable and face a shipwreck. In this article, we will describe how a stroke can cause the accumulation of water in this tissue.
Keywords: ictus, stroke, cerebral edema.
Introducción
Me arremolinaba entre sueños cuando un intrusivo tintinear me hizo incorporar precipitadamente. ¿El tono del celular en la madrugada? Estiré la mano en la oscuridad y contesté. Mis familiares me trataban de explicar que mi tío había sufrido un infarto cerebral. Todo había comenzado con un hormigueo en el brazo derecho que se fue extendiendo hasta llegar a la pierna. Mi tío había logrado sentarse sin esfuerzo y asir un vaso de agua que le ofrecieron; sin embargo, un instante después, su labio superior se había deformado, mostrando un horrible gesto que provocó el derrame del líquido como cascada desde sus labios. Imposibilitado para articular palabras, miró desesperado a los presentes y se derrumbó, perdiendo el conocimiento.
Lo llevaron de inmediato a urgencias, donde recibió uno de los dos tratamientos disponibles —no sólo en México ¡en el mundo!—, utilizados para liberar de la obstrucción a una arteria cerebral. Sus radiografías mostraron una mancha obscura que crecía sin remedio y oprimía su cerebro, a pesar de ser únicamente agua que de manera inexorable se acumulaba. Mis familiares me preguntaban afligidos por el teléfono: —¿Se supone que trabajas justo en este tipo de problemas? ¿O no? ¿Puedes hacer algo? Contesté: —Sí, en mi laboratorio buscamos compuestos que disminuyan el edema que se forma después de un infarto cerebral, pero son tratamientos en fase experimental, todavía no aprobados para su uso en humanos.
Afligida por la fatalidad de su destino, rememoré un documental del Titanic: el imponente barco promocionado por ser insumergible, pero que, a pesar de ser una extraordinaria obra de la ingeniería, la imprevisible naturaleza y una maniobra precipitada obligaron a la evacuación caótica de los pasajeros. Además, medidas de seguridad inadecuadas y la negligencia de su tripulación, o todo a la vez, provocaron el hundimiento del Titanic y la muerte de cientos de personas. Mi tío, durante varios días, viajó de su casa al hospital, mientras aquella pavorosa mancha crecía sin control en su cerebro, que, como trasatlántico devorado por el océano, finalmente naufragó. Mi tío falleció a las pocas semanas.
El cerebro, un coloso insumergible
La sangre inicia su viaje hacia todo el organismo utilizando las grandes arterias que nacen del corazón; algunas de éstas llegan al cerebro, en donde se unen formando una rotonda —el polígono de Willis—, que se bifurca repetidamente originando vasos sanguíneos que se internan, invadiendo hasta el rincón más alejado de este órgano. Como ramificada e intricada tubería, las arterias distribuyen la sangre en los tejidos y se adentran, disminuyendo progresivamente su diámetro, en ramales más pequeños, hasta llegar al punto donde los eritrocitos chocan, se amontonan, aunque finalmente se alinean, logrando avanzar. Allí, en los llamados capilares, la sangre realiza el intercambio de oxígeno y nutrientes con los tejidos, para posteriormente emprender el viaje de regreso, llevándose dióxido de carbono y desechos. Los vasos sanguíneos sufrirán el proceso inverso y aumentarán su diámetro progresivamente conforme atraviesan el tejido, llevando la sangre venosa hacia los pulmones y finalmente regresando al corazón (ver figura 1).
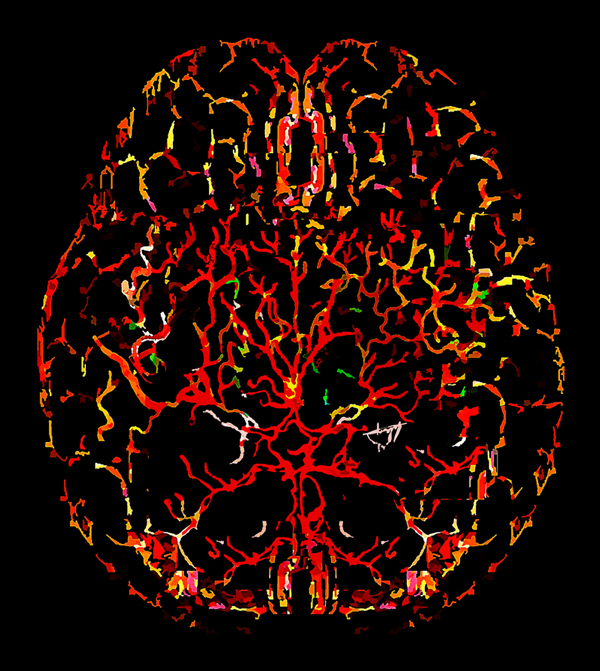
Figura 1. Ilustración de la vasculatura cerebral en una rebanada de cerebro humano (vista superior).
Crédito: elaboración propia.
A las paredes de estos vasos finísimos que transitan, protegen y alimentan al cerebro, se les conoce como barrera hematoencefálica. Estas paredes están constituidas por células aplanadas —el endotelio vascular cerebral— que se enrollan formando un tubo: se alinean una tras otra formando largas hileras y entrelazan fuertemente, sellando los espacios que existen entre ellas hasta impedir el paso de la sangre que viaja en su interior (ver figura 2).
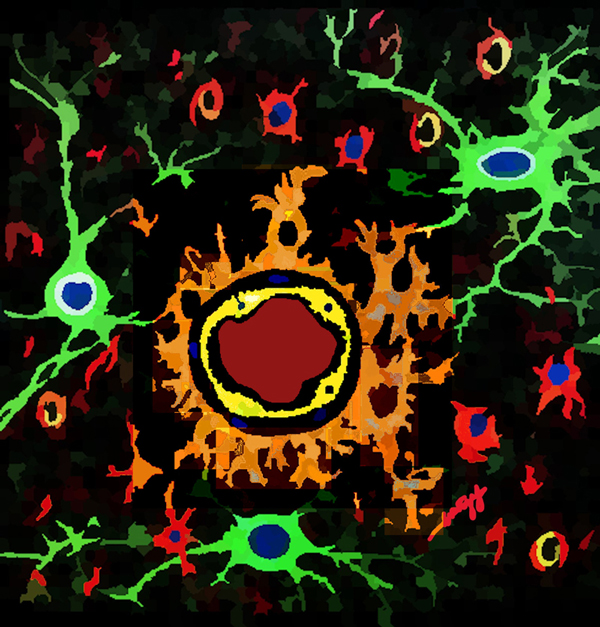
Figura 2. Ilustración de las células en el tejido cerebral. La luz del vaso sanguíneo (rojo), delimitada por el endotelio vascular cerebral (amarillo) y a su alrededor astrocitos (anaranjado), neuronas (verde) y microglia (rojo).
Crédito: elaboración propia.
Los nutrientes, la infinidad de moléculas contenidas en la sangre e inclusive el agua accederán al cerebro utilizando compuertas —llamadas canales, transportadores, intercambiadores, bombas, etcétera—, que con su diversidad adornan como orfebrería al endotelio. Las compuertas se abren y cierran, se tapan, se voltean o tuercen acarreando moléculas, se mueven desde el interior celular hacia la membrana o se asocian entre ellas, siempre buscando que el cerebro reciba en armonía los compuestos que le dan la vida y lo comunican con el resto del organismo. Este hermetismo regulado convierte al cerebro en un espacio seguro contra microorganismos (bacterias y virus), toxinas (consumidas consciente o inconscientemente), moléculas endógenas (como el glutamato, un aminoácido que forma parte de nuestra dieta pero que puede ser tóxico para el cerebro) e incluso el agua (cuyo ingreso en cantidades no controladas puede afectarlo). Sin embargo, los mecanismos de protección no son infalibles y en circunstancias patológicas se puede perder el control y, al igual que el Titanic, que aun teniendo un casco de doble fondo dividido en dieciséis compartimentos herméticos, que le permitirían permanecer a flote aún con cuatro de ellos inundados, naufragó.
El choque con el iceberg
El cerebro es un coloso voraz que consume el 25% de la energía aportada diariamente por los alimentos; esta energía la utiliza para mantener activas a muchas de sus proteínas y así cumplir su función. En la acumulación patológica de agua en el cerebro —conocida como edema cerebral— interviene de manera primordial una proteína denominada bomba de sodio y potasio (ATPasa Na+/K+), una máquina molecular incansable que en condiciones fisiológicas acarrea Na+ (cationes de sodio) desde el interior hacia fuera de la célula, intercambiándolo por K+ (cationes de potasio).
Durante un accidente cerebrovascular, conocido como infarto cerebral o ictus, la obstrucción de una arteria provoca que el flujo de sangre que normalmente baña a un territorio cerebral se interrumpa, causando que compuestos vitales como la glucosa y el oxígeno —de los que se obtiene energía— lleguen en cantidades insuficientes, y que las mínimas reservas energéticas del cerebro se agoten rápidamente. Sin energía disponible, la ATPasa Na+/K+ interrumpirá su trajinar, lo que provoca que el Na+ se estanque en el interior celular y se acumule el K+ en el exterior. En condiciones normales el K+ es rápidamente eliminado por los astrocitos —células que resguardan la integridad de las afamadas neuronas—, los cuales se adornan con un abundante número de canales de K+, para internalizarlo y mantener bajas sus concentraciones. Cuando hace falta la energía, como ocurre en el infarto cerebral, el astrocito recurrirá a un transportador de Na+/K+/Cl– que a su vez arrastrará agua.
En el infarto, los canales que transportan agua (acuaporinas) tapizan las membranas de los astrocitos; con esta puerta abierta, el agua entrará a la célula de forma descontrolada, con lo que el astrocito incrementará su tamaño. Entonces, al igual que en el naufragio del Titanic, el agua entrará por puertas y ventanas, bajando por escaleras, inundando pasillos, cuarto tras cuarto, como preámbulo de la gran inundación en la que el mar devorará al gran buque trasatlántico.
El quebrantamiento de los compartimentos de seguridad
El agua contenida en el cerebro está separada en cuatro compartimentos independientes entre sí. Primero, está la contenida en aproximadamente 100 mililitros de sangre —mezcla de plasma y células— que se mueve por esa tubería de vasos sanguíneos que es la barrera hematoencefálica. Segundo, el líquido intersticial cerebral, con una cantidad de 100 mililitros de agua con una composición iónica optimizada para facilitar la actividad neuronal y que circula entre las células. El tercer compartimento, denominado líquido cefalorraquídeo, es una recolección del líquido intersticial. Este líquido equivale a otros 100 mililitros de agua, que se concentra en grandes pozos llamados ventrículos, que baña al cerebro y la médula espinal. Por último, un poco más de 1000 mililitros está contenido dentro de las células que pueblan el sistema nervioso central, en el llamado espacio intracelular (ver figura 3).
Figura 3. El agua que circula en los diferentes compartimentos cerebrales.
Crédito: elaboración propia.
Toda esta masa de agua contenida en el cerebro se mantiene constante en un individuo sano y el volumen celular se regula controlando la movilización de iones, principalmente Na+, K+ y cloro (Cl−), de osmolitos orgánicos —moléculas que regulan la presión osmótica, por ejemplo, aminoácidos— y del agua, moviéndose a través de las membranas celulares, las cuales modifican su permeabilidad dependiendo de las características de las células que la revisten. Cuando se alteran las concentraciones de Na+ y K+, se incrementa la entrada de agua desde el espacio intersticial, inicialmente hacia los astrocitos, sin provocar cambios en el contenido total de agua en el cerebro. Sin embargo, la falta continuada de Na+ en el espacio extracelular también tendrá que compensarse y generará una fuerza que tendrá como objetivo restaurar el gradiente de Na+ en el cerebro. Para conseguirlo, algunas proteínas localizadas en la barrera hematoencefálica acarrearán Na+ proveniente de la sangre. Nuevamente, las acuaporinas harán su aparición dramática y la entrada de Na+ arrastrará grandes cantidades de agua desde el torrente sanguíneo, lo que provocará la hinchazón de las células que forman la barrera hematoencefálica. Simultáneamente, otros procesos dañarán las proteínas que mantienen unidas estrechamente las membranas del endotelio, las cuales se desensamblarán, como los pernos y remaches del casco del Titanic saldrán volando al no resistir la presión, y dejarán espacios entre las células por donde las moléculas circulantes en la sangre tendrán acceso al cerebro. Los vasos perderán gradualmente su integridad y el cambio de volumen provocará la muerte de las células, que por último se contraerán, dejando enormes huecos en la barrera hematoencefálica. Es así que, con el paso libre al torrente sanguíneo, entrará sangre al cerebro y con ella se incrementará notablemente el volumen de agua.
Así, durante un edema celular, como en aquella noche oscura, sin luz de luna y con el mar en calma, que impidió visualizar al monstruoso iceberg, el cerebro, al igual que el oficial al mando, intentará evitar el choque. Sin embargo, esto hará que el agua penetre a gran velocidad y que, como el Titanic, ese colosal trasatlántico a prueba de hundimientos, naufrague.
El naufragio
Mantener el equilibrio osmótico en el cerebro es importante porque cualquier aumento en el volumen de agua causa un daño severo, el cual no es comparable al de ningún otro órgano, por estar contenido dentro del cráneo, esa estructura rígida y dura que lo protege, pero que limita su expansión. Cuando el cerebro incrementa su volumen ejerce una fuerza mecánica contra el cráneo que incrementa la presión interna. Cuando la presión en el tejido excede la presión interna de la sangre en los vasos sanguíneos, el interior de los vasos se colapsa, precipitándose hacia la formación del edema.
La inundación del territorio cerebral provoca lo que clínicamente se denomina edema cerebral que consiste en su expansión por aumento de fluidos en el tejido. Esto tiene un impacto crucial en la morbilidad y la mortalidad de las personas que desarrollan edema a causa de una enfermedad neurodegenerativa, un tumor, un infarto cerebral o un golpe fuerte. En el edema, de manera similar al hundimiento del Titanic, que albergaba 3300 personas y del cual lograron sobrevivir solo 1500, muchas de las neuronas y astrocitos no podrán ser rescatados y perecerán durante el colapso del coloso que se hundirá hasta las profundidades (ver figura 4).

Figura 4. El naufragio del cerebro. Se ilustra el edema cerebral ocurrido en un ictus simulando el naufragio del trasatlántico Titanic en 1912.
Crédito: elaboración propia.
Conclusión
La enfermedad vascular cerebral es una de las primeras causas de muerte a nivel mundial, con 93.8 millones de casos prevalentes y 11.9 millones de casos nuevos en 2021, siendo la séptima causa de muerte en los mexicanos. Adicionalmente, enfermedades crónicas como la hipertensión arterial, la diabetes mellitus, el sobrepeso y la obesidad están asociadas con el riesgo de sufrir un infarto cerebral, el cual a nivel mundial se ha incrementado hasta un 50% en los últimos 17 años. Es así como se ha declarado el 29 de octubre como el día mundial del ictus, una enfermedad que debe atenderse durante los primeros minutos para evitar secuelas incapacitantes o inclusive el fallecimiento.
Con la intención de prevenir daños, actualmente los trasatlánticos cuentan con nuevas medidas de seguridad, que permitirán, en caso de accidente, un adecuado proceso de evacuación; además, los avances tecnológicos como el uso de gps y diseño de radares para detectar icebergs, ayudan a prevenir incidentes. Lo mismo busca la medicina moderna y la investigación en biomedicina: reducir las muertes y el estado de incapacidad a la que se ven sometidas los individuos que sufren de algún padecimiento que provoca la formación del edema cerebral como los infartos.
Primero, es importante incrementar los factores protectores, como realizar actividad física y tener una dieta baja en sales, carbohidratos y grasas; así como reducir los factores de riesgo como fumar y consumir bebidas alcohólicas. En segundo lugar, deben mejorarse los tiempos de diagnóstico y tratamiento en los hospitales (uso de trombolíticos y eliminación mecánica del trombo o coágulo) teniendo como meta alcanzar tiempos menores a 90 minutos. Para esto, es importante que el individuo identifique los síntomas (confusión repentina, dificultad para hablar o entender, debilidad o parálisis muscular unilateral o vista borrosa) y acuda al hospital. Finalmente, se trabaja con modelos experimentales que permitan entender los mecanismos que provocan los infartos cerebrales y se buscan compuestos que reduzcan el daño ocasionado al cerebro.
Actualmente, el laboratorio de Patología Vascular del Instituto Nacional de Neurología y Neurocirugía colabora con un grupo especializado en la evaluación del flujo iónico de canales de la unam, para investigar la participación de este flujo iónico de canales en la formación del edema cerebral. En el futuro podremos aplicar los conocimientos adquiridos con modelos experimentales en la clínica, en donde la aplicación de los tratamientos a pacientes que han sufrido un infarto podría reducir las secuelas e incluso prevenir su muerte.
Agradecimientos
El apoyo financiero fue brindado por el conacyt al proyecto CIENCIA FRONTERA CF-2019/170733 otorgado a pa y fordecyt-pronaces 21887 y papiit unam IN216523 a a-hc. Agradecemos la beca postdoctoral otorgada conachyt-México a I-AB (cvu 445084) y de doctorado a a-mb (957183).
Referencias
- gbd 2021 Stroke Risk Factor Collaborators. (2024, octubre). Global, regional, and national burden of stroke and its risk factors, 1990-2021: a systematic analysis for the Global Burden of Disease Study 2021. The Lancet Neurology, 23(10), 973-1003. https://doi.org/10.1016/S1474-4422(24)00369-7
- Nigri, W., Godoy, D., y Recalde, R. (1998). Fisiología del edema cerebral. Revista Argentina de Neurocirugía, 12(3-4),155-162. https://aanc.org.ar/ranc/items/show/803
- Stokum, J. A., Gerzanich, V., y Simard, J. M. (2016). Molecular pathophysiology of cerebral edema. Journal of Cerebral Blood Flow & Metabolism, 36(3), 513-538. https://doi.org/10.1177/0271678X15617172
Recepción: 2023/08/24. Aprobación: 2024/11/19. Publicación: 2025/01/13.