Vol. 26, núm. 1 enero-febrero 2025
CO2 y vida marina: una conexión que debemos entender
Metzli Romero y Anaid Flores CitaResumen
El incremento de la concentración de dióxido de carbono en la atmósfera tiene el potencial de disminuir los niveles de pH en el océano y de afectar el sistema de carbonatos marino. En este trabajo se explica la química de la acidificación del océano y sus consecuencias en algunas especies marinas, así como los proyectos nacionales e internacionales encaminados a mitigar e investigar los cambios en el pH del océano. Es necesario dirigir los esfuerzos de monitoreo, investigación y educación con relación a la dinámica de los ciclos biogeoquímicos, en los mares y costas de México.
Palabras clave: acidificación del océano, cambio climático, educación ambiental, dióxido de carbono, interacción océano-atmósfera.
CO2 and marine life: a connection we need to understand
Abstract
Increased concentration of carbon dioxide in the atmosphere has the potential to lower pH levels in the ocean and affect the marine carbonate system. This paper explains the chemistry of ocean acidification and its consequences on some marine species, as well as national and international projects aimed at mitigating and investigating changes in ocean’s pH. It is necessary to direct monitoring, research, and education efforts about the dynamics of biogeochemical cycles, in the seas and coasts of Mexico.
Keywords: ocean acidification, climate change, environmental education, carbon dioxide, ocean-atmosphere interaction.
Introducción: el origen del CO2
La contaminación del medio ambiente se deriva de las actividades realizadas por los seres humanos, aquellas denominadas actividades antropogénicas. Entre ellas, se encuentran, por ejemplo, la quema de combustibles fósiles usados para el transporte y la producción de energía eléctrica, y los cambios en el uso de suelo por el aumento de actividades como la agricultura, la ganadería y la minería, la pesca industrial, la construcción, la deforestación, etcétera.
El incremento en la concentración de los Gases de Efecto Invernadero (gei), tales como el dióxido de carbono (CO2), el metano (CH4), el óxido nitroso (N2O) y los gases fluorados, originados por las actividades antropogénicas, ha provocado un desequilibrio térmico en la atmósfera. Una consecuencia de esto es un incremento en la temperatura media global, que es lo que conocemos como calentamiento global (Feely et al., 2009). Pero eso sólo es una parte del problema climático, ya que, además de incrementar la temperatura, el aumento de CO2 está acidificando los océanos.
Desde el comienzo de la revolución industrial se han emitido más de 500,000 millones de toneladas de dióxido de carbono o CO2 a la atmósfera. Hoy en día la concentración de CO2 se registra como la más elevada de los últimos 800,000 años (ipcc, 2023). Esta concentración sería mucho mayor si no fuera por el papel clave que tienen los océanos en la eliminación de CO2 atmosférico. Y es que el océano funciona como un amortiguador en el planeta, ya que es un sistema abierto que intercambia de forma permanente flujos de calor, energía y gases a través de su superficie con la parte inferior de la atmósfera.
De esta manera, al incrementar la concentración de CO2 en la atmósfera se incrementa la cantidad de CO2 que se puede disolver en el océano. Si bien esto es excelente para disminuir la concentración de este gas en la atmósfera, a la par, provoca una disminución del pH oceánico. Por ejemplo, en la figura 1 podemos observar una tendencia en el crecimiento de la concentración de CO2 atmosférico entre los años 1958 y 2018 en el observatorio de Mauna Loa, Hawai. Entonces, así como aumenta la cantidad de CO2 en la atmósfera, también se incrementa el CO2 disuelto en el océano, lo que está estrechamente ligado con la disminución del pH.
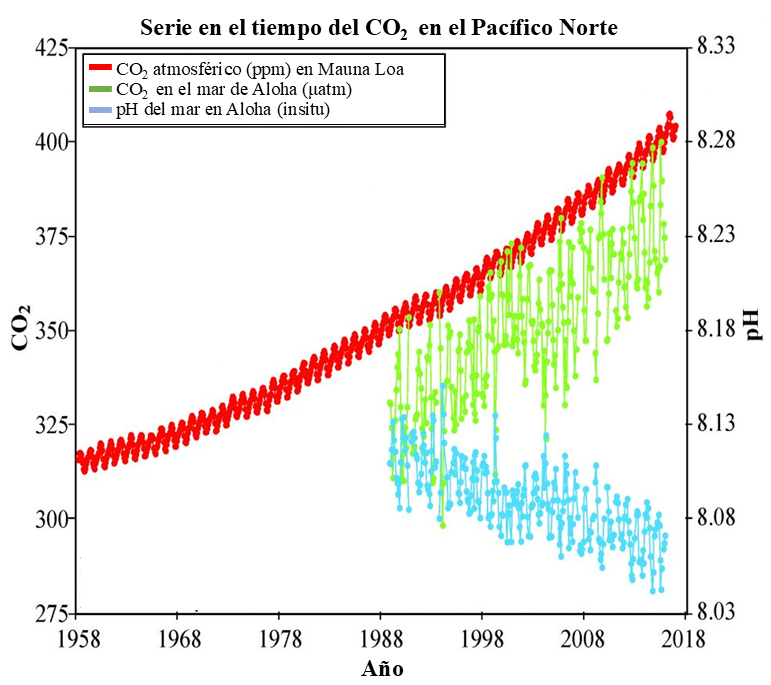
Figura 1. Se observa el aumento del CO2 atmosférico (ppm) registrado en el observatorio de Mauna Loa, Hawai desde 1958 a 2018 (línea roja). También se muestran los cambios del CO2 del agua de mar (verde) y el pH (azul) en las islas hawaianas observadas en la estación oceánica Aloha, muy cerca de Mauna Loa. Crédito: modificado de Webb, 2023.
Si bien el pH oceánico promedio puede variar en escalas de tiempo interglaciares (40.000-100.000 años), la tasa de acidificación actual es 10 veces más alta que en los últimos 55 millones de años (Comisión Oceanográfica Intergubernamental, Comité Científico de Investigaciones Oceánicas, Programa Internacional sobre la Geosfera y la Biosfera, 2013). Además, factores regionales como la presencia de surgencias costeras,1 los cambios en las tasas de descarga de ríos y glaciares, la pérdida de hielo marino y la urbanización, han creado “puntos críticos de acidificación del océano”, en donde los cambios se están produciendo a un ritmo aún más rápido (Comisión Oceanográfica Intergubernamental, Comité Científico de Investigaciones Oceánicas, Programa Internacional sobre la Geosfera y la Biosfera, 2013).
Acidificación: desequilibrio en el sistema de carbonatos del océano
La absorción de CO2 en el océano es un proceso natural y esencial para mantener el equilibrio del clima en la Tierra. Este proceso ayuda a moderar el efecto invernadero y el calentamiento global, e implica de forma general los siguientes pasos:
1. Disolución del CO2. El CO2 de la atmósfera se disuelve en el agua del mar (ver figura 2a).
2. Formación de ácido carbónico. El CO2 disuelto reacciona con el agua formando ácido carbónico (H2CO3) (ver figura 2b).
3. Disociación. El ácido carbónico se disocia en ion bicarbonato (HCO3–) y protones (H3–), o en ion carbonato (CO32-) y más protones (ver figura 2c).
Estas especies químicas se encuentran en el océano en diferentes proporciones, aproximadamente el 87% del carbono inorgánico se encuentra presente como bicarbonato, el 12% es carbonato, el ácido carbónico y el dióxido de carbono representan cerca del 1% y forman lo que se conoce como sistema de carbonatos marino (Libes, 2009). El equilibrio entre estas proporciones de especies químicas, principalmente la del ion carbonato (HCO32-) y el ion bicarbonato (HCO3–), es la razón por la que el océano tiene un pH ligeramente básico (alrededor de 8.1) (Jiang et al., 2019).
El exceso de absorción de CO2 provoca un desbalance en el sistema de carbonatos, resultando en un aumento de protones (H+) y, por lo tanto, en una disminución del pH del agua, lo que hace que el océano se vuelva más ácido. Aunque el agua de mar tiene una capacidad natural para amortiguar estos cambios de pH, ésta no es infinita. La capacidad del océano de amortiguar disminuirá y la mayor parte de carbonato será consumido (Barker, S. y Ridgwell, 2012).
La presencia del ion carbonato es esencial para el mecanismo de fabricación de estructuras esqueléticas como conchas y caparazones de organismos calcificadores.2 A partir de los iones de calcio (Ca2+) y carbonatos (CO32-) presentes en el agua de mar se genera carbonato de calcio (CaCO3), que sirve para recubrir gradualmente sus partes blandas (ver figura 2d).
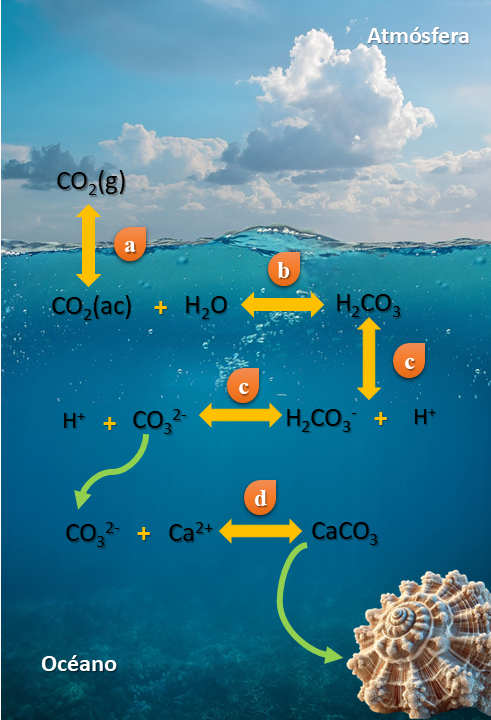
Figura 2. Reacciones presentes en el proceso de acidificación, más la precipitación de carbonato de calcio. El exceso de CO2 provoca un desequilibrio en el sistema de carbonatos marino. Crédito: elaboración propia.
Durante la década de los noventa se reveló que los océanos habían absorbido el 30% del CO2 emitido por la humanidad en los dos últimos siglos (Feely, et al 2009), y actualmente siguen absorbiendo alrededor de un millón de toneladas por hora (Brewer, 2008; Jiang et al., 2019). Estudios previos han revelado la presencia de aguas corrosivas no sólo en Canadá y Estados Unidos de América, sino también en costas mexicanas (Paz-Pellat, et al., 2019). En la figura 3 podemos apreciar la tasa de disminución promedio global del pH oceánico de 1990 a 2025 (un cambio de -0.019 pH por década), y la distribución de pH en el planeta registrada en el año 2023. Podemos observar que los océanos que rodean a México registran una tendencia a valores promedio de pH entre 8 y 8.04 durante el 2023. Podemos observar que los océanos que rodean a México registran una tendencia a valores promedio de pH entre 8 y 8.04 durante el 2021. El valor promedio del pH de los océanos es de 8.1, y se ha previsto que para el año 2100 se alcanzará un valor promedio global de 7.7 (Jiang et al., 2019).
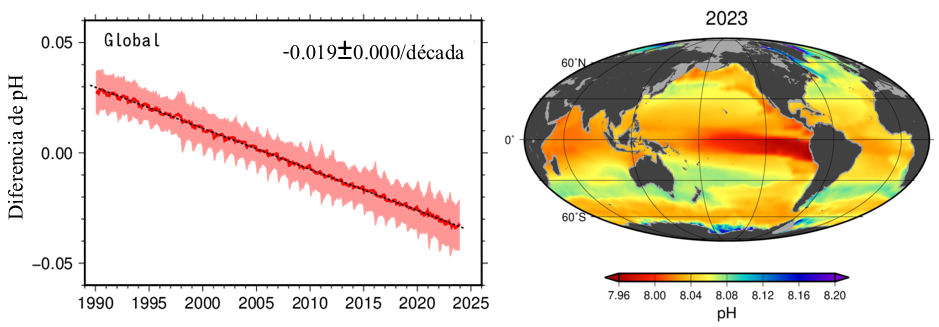
Figura 3. Izquierda: tasa de cambio del pH. La línea central roja representa la anomalía del pH normal y la franja exterior es la desviación estándar. Derecha: distribución global del pH oceánico registrada en 2021. Crédito: Ocean acidification in the global ocean. Japan Meteorological Agency.
¿Cómo afecta la acidificación a los organismos marinos?
La disminución del pH del océano tiene el potencial de afectar la vida de todos los organismos marinos, ya que cada uno de ellos gasta energía metabólica para mantener un pH regular dentro de sus células (Raven et al., 2005), y de esta forma asegurarse de que los procesos bioquímicos en su interior sigan funcionando de manera eficiente. Algunas de las especies que han sido afectadas son los corales, las estrellas marinas, las ostras, los cangrejos, las gambas, los mejillones, las langostas, los cocolitofóridos (organismos que conforman al fitoplancton), los pterópodos (caracoles marinos) e incluso los cetáceos.
Mamíferos marinos
Los mamíferos marinos (ballenas, delfines, cachalotes, lobos marinos, por mencionar algunos) emplean el sonido en el agua para orientarse, comunicarse y reproducirse. Cuando un mamífero marino emite sonido en una determinada frecuencia, el sonido se aleja desde éste de forma radial y viaja a través del agua en forma de ondas sonoras, que son absorbidas y reflejadas por todas las partículas suspendidas en el agua, otros organismos o por paredes rocosas. Se ha documentado (Brewer y Hester, 2009) que al disminuir el pH del agua de mar las frecuencias de sonido, incluyendo las que utilizan los mamíferos marinos, se pueden propagar de forma más eficiente. Esto se debe a que los iones borato presentes en el agua de mar, que absorben estas frecuencias de sonido, se agotan de la misma manera que ocurre con el ion carbonato cuando incrementa la presencia de CO2. La consecuencia directa de esto es una alteración en la comunicación de los cetáceos, y un incremento en la contaminación marina por ruido, proveniente de embarcaciones y plataformas petroleras. La absorción de sonido por el ion borato está incorporado en todas las ecuaciones que describen y predicen la absorción de sonido en el océano.
Pterópodos
Los pterópodos o mariposas marinas son en su mayoría organismos calcificadores pelágicos (que viven suspendidos en la columna de agua), que miden menos de 1 cm. Éstos son muy importantes para el buen funcionamiento de la red trófica marina, debido a que son consumidos por organismos tan pequeños como el krill y hasta por los de mayor tamaño como las ballenas. La figura 4 muestra cómo se disuelve o adelgaza el caparazón de un pterópodo en el transcurso de 45 días, al colocarlo en agua de mar con niveles de pH y carbonato proyectados para el año 2100 (Orr, et al., 2005).

Figura 4. Foto de un pterópodo antes y después de la acidificación. Crédito: modificado de Webb, 2023.
Corales
El incremento de la temperatura debido al calentamiento global es una causa de estrés en los corales que provoca su blanqueamiento (ver figura 5). De esta manera, el coral pierde el color debido a que expulsa el alga simbiótica. Entonces, un mar ácido causaría que el coral se degrade o se disuelva, con lo que se reduciría significativamente la capacidad de los corales formadores de arrecifes para producir sus esqueletos (Libes, 2009).

Figura 5. Coral en Samoa Americana antes, durante, y después de un evento de blanqueamiento de coral. Crédito: modificada de The Ocean Agency, s.f.
Los corales proporcionan albergue para cerca del 25% de todas las especies oceánicas y cubren sólo el 1% de la superficie terrestre, por lo que juegan un papel clave en el ecosistema marino. Además, los corales son una barrera natural que bloquea, frena y desvía la energía oceánica proveniente de tormentas y del oleaje intenso.
Acciones globales y nacionales contra la acidificación del océano: medidas de mitigación y observaciones
La mitigación de la acidificación oceánica puede requerir de objetivos diferentes a aquellos orientados contra el cambio climático. Esto es porque la reducción de emisiones de otros gases de efecto invernadero no tiene un efecto significativo sobre la acidificación de los océanos, ya que el único gas de interés para mitigarla es el CO2. Ante esta situación se han formado grupos de trabajo internacionales y nacionales, dentro de las cuales podemos mencionar:
1. El Centro Internacional de Coordinación de Acidificación de los Océanos (oa-icc, por sus siglas en inglés) promueve la colaboración internacional sobre el monitoreo y estudio de la acidificación de los océanos. La oa-icc organiza cursos de formación en los estados miembros, y proporciona acceso a datos y recursos para promover la investigación sobre la acidificación de los océanos.
2. La Comisión Oceanográfica Intergubernamental (coi) de la unesco y su Sección de Ciencias Oceánicas participan en la coordinación de varios programas para vigilar y estudiar la acidificación de los océanos y sus efectos.
3. El Programa de acidificación de los océanos de la Administración Nacional Atmosférica y Oceánica (noaa, por sus siglas en inglés) busca preparar mejor a la sociedad para responder a las condiciones y los recursos oceánicos cambiantes, mediante la ampliación de la comprensión de la acidificación de los océanos a través de asociaciones interdisciplinarias, a nivel nacional e internacional.
4. Los científicos del equipo de acidificación, clima y ecosistemas de arrecifes de coral (accrete, por sus siglas en inglés), de la División de Química y Ecosistemas Oceánicos (oced, por sus siglas en inglés), del laboratorio meteorológico y oceanográfico del Atlántico (aoml’s, por sus siglas en inglés), han implementado una herramienta de monitoreo para el Golfo de México y el mar caribe con datos de temperatura superficial del mar (obtenida por satélites), salinidad superficial del mar (calculada con el modelo oceánico hycom3) y midiendo la alcalinidad total con titulación química. Este conjunto de información les ha permitido obtener la variabilidad anual del pH superficial en el Golfo de México y el resto de las especies del sistema de carbonatos del agua de mar.
5. Desde 2018 México cuenta con el Sistema de Modelos numéricos y climáticos (simod), que son parte del Sistema de Información y Análisis Marino Costero (simar), de la Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (conabio). Éste tiene como objetivo desarrollar conocimiento de los mares y costas para su conservación y uso sostenible, en respuesta a las necesidades del país bajo el contexto de cambio y variabilidad climática, contribuyendo al bienestar y la salud de las personas. El simar integra datos satelitales, modelos climáticos y datos in situ, sobre parámetros físicos y químicos en diferentes escalas de tiempo.
Es importante reconocer las herramientas con las que se cuentan actualmente en nuestro país, para facilitar el desarrollo de estudios encaminados a determinar la distribución promedio y la variabilidad anual e interanual del sistema de carbonatos marino, así como la distribución y variabilidad del pH a lo largo de nuestra zona costera y mares territoriales. De igual manera, se requieren estudios más complejos que aborden la exposición de organismos marinos, de importancia ecológica y comercial en México, a los efectos de la disminución del pH.
También es indispensable seguir promoviendo medidas de cuidados y conservación de las ballenas alrededor del mundo, pues éstas son capaces de almacenar cantidades considerables de CO2 a lo largo de su vida. Por ejemplo, las ballenas azules pueden almacenar hasta 63 toneladas de CO2 y las ballenas rorcual aliblanco, 2.2 toneladas por individuo. Y cuando las ballenas mueren, en la mayoría de los casos, se hunden en el fondo del océano, sepultando el CO2 que fue capturado a lo largo de su ciclo de vida (Noticias onu, 2022).
Conclusiones
La acidificación oceánica es una consecuencia directa del incremento de las emisiones de CO2 a la atmósfera, derivado de las actividades antropogénicas y se ha acelerado drásticamente desde la Revolución industrial.
La disminución del pH oceánico está provocando impactos negativos en diversas especies marinas, desde los corales hasta los mamíferos marinos, afectando sus capacidades de supervivencia, reproducción y comunicación.
La comprensión y la mitigación de la acidificación oceánica requieren esfuerzos específicos y diferenciados de los objetivos generales del cambio climático, ya que la única forma de abordar este problema es reduciendo las emisiones de CO2. Las iniciativas nacionales e internacionales mencionadas en este artículo, como la oa-icc, la coi de la unesco y el Programa de acidificación de los océanos de la noaa, están trabajando para mejorar el monitoreo, la investigación y la colaboración global en este ámbito.
En México, la implementación del Sistema de Modelos Climáticos océano-atmósfera (simod) ha sido un paso importante hacia la conservación y el uso sostenible de los recursos marinos. Es imperativo continuar y ampliar estos estudios para comprender mejor la distribución, la variabilidad del pH y el sistema de carbonatos en nuestras costas y mares territoriales (Paz-Pellat, et al., 2019).
Es esencial promover la conservación de especies marinas clave como las ballenas, que desempeñan un papel significativo en la captura y almacenamiento de CO2. La protección de estos animales no sólo contribuye a la biodiversidad, sino también a los esfuerzos globales para mitigar el cambio climático.
La educación ambiental y la concienciación pública, sobre la acidificación del océano y sus impactos, son fundamentales para fomentar cambios en las políticas y comportamientos que reducen las emisiones de CO2. Únicamente a través de un enfoque integral que combine tanto la investigación multidisciplinaria y transdisciplinaria, como la acción política y la participación comunitaria, podremos enfrentar eficazmente este desafío y proteger nuestros océanos para las generaciones futuras.
Referencias
- Álvarez-Lires, M. M., Arias-Correa, A., Lorenzo-Rial, M. A., y Serrallé-Marzoa, F. (2017). Educación para la Sustentabilidad: Cambio Global y Acidificación Oceánica. Formación Universitaria, 10(2), 89-102. http://dx.doi.org/10.4067/S0718-50062017000200010
- Barker, S., y Ridgwell, A. (2012). Ocean Acidification. Nature Education Knowledge 3(10), 21. https://tinyurl.com/mvjd54wp
- Brewer, P. G. y Hester, K. (2009). Ocean acidification and the increasing transparency of the ocean to low-frequency sound. Oceanography, 22(4), 86-93. https://doi.org/10.5670/oceanog.2009.99
- Caldeira, K., y Wickett, M. E. (2003). Oceanography: Anthropogenic carbon and ocean pH. Nature, 425, 365. https://doi.org/10.1038/425365a
- Cerdeira-Estrada, S., Martell-Dubois, R., Valdez-Chavarin, J., Rosique-de la Cruz, L., Caballero-Aragón, H., Santamaria-del-Angel, E., López-Perea, J., Perera-Valderrama, S., y Ressl, R. (2024). pH de la superficie marina a 1 km. Sistema de Modelos Numéricos y Climáticos (simod). Sistema de Información y Análisis Marino Costero (simar), Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (conabio). https://simar.conabio.gob.mx/simod/
- Feely, R. A., Doney, S. C., y Cooley, S. R. (2009). Ocean Acidification: Present Conditions and Future Changes in a High- CO2 World. Oceanography, 22(4), 36-47. http://www.jstor.org/stable/24861022
- Comisión Oceanográfica Intergubernamental, Comité Científico de Investigaciones Oceánicas, Programa Internacional sobre la Geosfera y la Biosfera. (2013). La acidificación del océano. Resumen para responsables de políticas. Tercer simposio. El océano es un mundo con altos niveles de CO2. Programa Internacional Geosfera-Biosfera, Estocolmo, Suecia. https://unesdoc.unesco.org/ark:/48223/pf0000224724_spa
- Intergovernmental Panel on Climate Change (ipcc). (2023). Biodiversity Hotspots. En Climate Change 2022 – Impacts, Adaptation and Vulnerability: Working Group ii Contribution to the Sixth Assessment Report of the Intergovernmental Panel on Climate Change (pp. 2123-2162). Cambridge University Press.
- Japan Meteorological Agency. (s. f.). Long-term trend of surface seawater. https://www.data.jma.go.jp/gmd/kaiyou/english/oa_global/oceanacidification_global_en.html
- Jiang, L. Q., Carter, B. R., Feely, R. A., Lauvset, S. K., y Olsen, A. (2019) Surface Ocean pH and buffer capacity: past, present and future. Scientific Reports, 9(18624). https://doi.org/10.1038/s41598-019-55039-4
- Libes, S. M. (2009). Introduction to marine biogeochemistry. Academic Press.
- Noticias onu. (2022, 16 de julio). Las ballenas, aliadas en la lucha contra el cambio climático. https://news.un.org/es/story/2022/07/1511692
- Orr, J. C., Fabry, V. J., Aumont, O., Doney, S. C., Feely, R. A., Gnanadesikan, A., Gruber, N., Ishida, A., Fortunat Joos, F., Key, R. M., Keith Lindsay, K., Maier-Reimer, E., Matear, R., Monfray, P., Mouchet, A., Najjar, R. G., Plattner, G.-K., Rodgers, K. B., Sabine, C. L., Sarmiento, J. L., Schlitzer, R., Slater, R. D., Totterdell, I. J., Weirig, M-F., Yamanaka, Y., y Yool, A. (2005). Anthropogenic Ocean acidification over the twenty-first century and its impact on calcifying organisms. Nature, 437, 681-686. https://doi.org/10.1038/nature04095
- Paz-Pellat, F., Hernández-Ayón, J. M., Sosa-Ávalos R., y Velázquez-Rodríguez, A. S. (Eds.). (2019). Estado del Ciclo del Carbono: Agenda Azul y Verde. Programa Mexicano del Carbono. https://tinyurl.com/yhy59h26
- Raven, J., Caldeira, K., Elderfield, H., Hoegh-Guldberg, O., Liss, P., Riebessell, U., Quinn, R. (2005). Ocean acidification due to increasing atmospheric carbon dioxide. The Royal Society. https://tinyurl.com/2ajrrtwv
- The Ocean Agency. (s.f.). Coral Bleaching, American Samoa: Before (healthy Dec 2014), during bleaching (Feb 2015), and after (dead August 2015). [Fotografía]. Before & after The Ocean Agency, https://www.theoceanagency.org/ocean-image-bank/before-and-after
- Webb, P. (2023). 5.5 Dissolved Gases: Carbon Dioxide, pH, and Ocean Acidification. En Introduction to Oceanography. Pressbook. https://tinyurl.com/dk5sm8bx
Recepción: 2023/08/15. Aprobación: 2024/11/13. Publicación: 2025/01/13.