

La espuma, presente en nuestra vida cotidiana
Introducción
Todos los días nuestras actividades comunes nos ponen en contacto con este químico, y sólo necesitamos saber que sirve para limpiar, que suele tener un olor agradable y que sus formas pueden ser variadas. Sin embargo, poca información poseemos respecto a su composición química. Este artículo refiere cómo, a través de la historia, el papel del jabón ha sido importante para el desarrollo de nuevas tecnologías, derivadas de las necesidades globales de la sociedad. El impacto de la demanda de este producto se observa en los métodos empleados para elaborarlo. La química detrás de este producto responde a varias incógnitas: ¿Cómo funciona un jabón? ¿Por qué hace burbujas? ¿Por qué limpia? ¿De dónde viene? ¿Por qué sus diferentes presentaciones? ¿Es lo mismo jabón y detergente?
Todo comienza con las grasas de origen animal o aceites vegetales que se transforman en jabones. No es cuestión de magia: Esto se llama química, e implica una reacción muy sencilla denominada saponificación (WADE, 2004). Un jabón contiene las sales de sodio o potasio de los ácidos grasos, producto de la mezcla de un cuerpo graso (triglicéridos con un álcali, que puede ser hidróxido de sodio o de potasio).
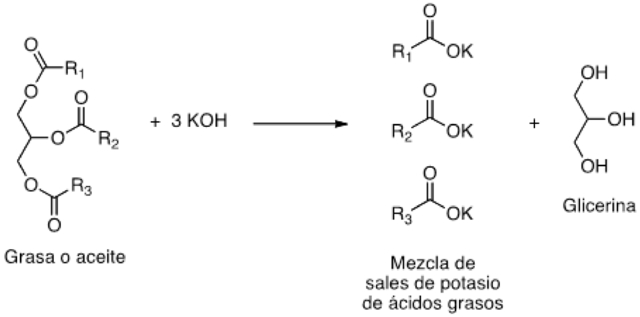
Figura 1. Esquema de reacción de saponificación para la producción de jabón.
¿Cómo funciona un jabón?
Como si se tratara de una batería con polos positivo y negativo, una molécula de jabón también tiene dos extremos de diferente afinidad.La Figura 2 representa una molécula de jabón. En rojo, la cabeza, con carga, es afín al agua porque son de polaridad similar. La cadena azul, denominada lipofílica, es afín a las grasas y repele al agua (CLAYDEN, 2005). A causa de esta estructura, el jabón posee una doble afinidad hacia la polaridad de otras moléculas y puede orientarse según el medio donde se encuentre.
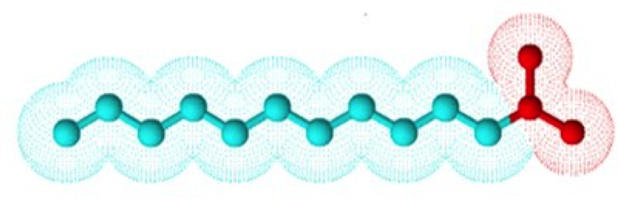
Figura 2. Una molécula de jabón, la cabeza roja con carga interactúa con el agua, mientras que la cadena azul sin carga se mezcla con las grasas o aceites.
Alguna vez hemos escuchado la frase “Tú y yo somos como el aceite y el agua, jamás podremos estar juntos”. Palabras muy fuertes. Es probable que quien usa esta expresión no conozca la química de un jabón, que puede disminuir la tensión superficial y, con ello, crear un efecto de emulsificación que es algo muy cercano a mezclarse.
En el agua, el jabón forma entre 100 y 200 micelas; es decir, asociaciones o conglomerados de moléculas que orientan sus cabezas con carga hacia la superficie del agregado molecular, mientras que las cadenas alifáticas quedan hacia dentro. La micela es una partícula energéticamente estable, ya que los grupos con carga están unidos mediante enlaces de hidrógeno de baja energía con las moléculas del agua circundante, mientras que los grupos afines a las grasas se orientan hacia el interior de la micela e interactúan con otros grupos de características similares.
Los jabones limpian debido a las afinidades diferentes de los extremos de sus moléculas. La suciedad grasa no se elimina fácilmente sólo con agua, que la repele por ser insoluble en ella. Sin embargo, el jabón posee una cadena larga alifática o hidrocarbonada sin carga que interactúa con la grasa, disolviéndola, mientras que la región con carga se orienta hacia el exterior, formando gotas. Una vez que la superficie de la gota grasa está cubierta por muchas moléculas de jabón, se forma una micela con una pequeña gota de grasa en el interior. Esta gota de grasa se dispersa fácilmente en el agua, ya que está cubierta por las cabezas con carga o aniones carboxilato del jabón, como se observa en la Figura 3. La mezcla que resulta de dos fases insolubles (agua y grasa), con una fase dispersada en la otra en forma de pequeñas gotas, se denomina emulsión. Por lo tanto, se dice que la grasa ha sido emulsionada por la solución jabonosa. De esta manera, en el proceso de lavado con un jabón, la grasa se elimina con el agua del lavado.
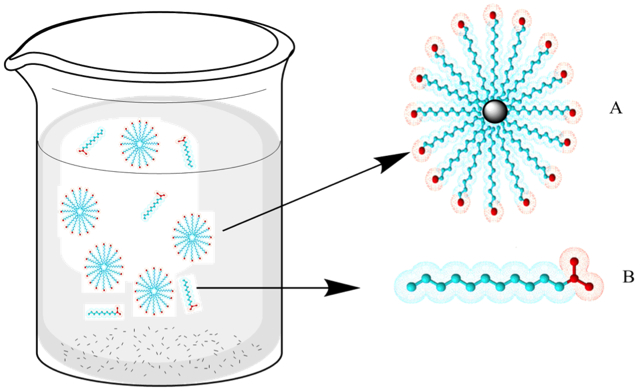
Figura 3. Formación micelar en un entorno acuoso, donde A es una micela y B es una molécula de jabón.
Antecedentes históricos

Figura 4. Tabla Sumeria, tomada de http://www.cosmeticanatural100x100.es/breve-historia-del-jabon-primera-parte/ El jabón ocupa hoy un lugar esencial en la sociedad. Atrae por su aroma, su textura y sus burbujas, atributos que determinan el uso especial que se le ha dado desde las primeras civilizaciones. Aunque no se puede precisar la fecha exacta en que se preparó por primera vez, existen indicios de que ya se usaba en 2500 a.C. Los habitantes de Sumeria, según una tableta de arcilla de escritura cuneiforme, utilizaban para lavar la lana una sustancia preparada mezclando agua, un álcali y aceite de acacia (SPITZ, 2010). Se cree que la palabra jabón, del latín saponem, proviene de la montaña Sapo, donde se sacrificaban animales cuya grasa, fundida, era arrastrada junto con las cenizas y el barro hasta las orillas del Tiber (WILCOX, 2000).
El papiro de Ebers, tratado médico que data de 1500 a.C., sostiene que los egipcios usaban jabón como ungüento para curar infecciones de la piel (BARDINET, 1995); además, perfeccionaron su producción mezclando grasa animal y aceites vegetales, sales alcalinas y cenizas si deseaban una sustancia espumosa. En el reinado de Nabónido (556-539 a.C.) en Babilonia, lo preparaban con aceite de sésamo, cenizas y ciprés, aunque era utilizado para lavar superficies (LEVEY, 1958). Para los hebreos, el baño significó además limpieza espiritual: el libro de Jeremías (627 a.C.) contiene la palabra hebrea bôrîth, que significa “vegetal alcalino”, el cual probablemente fue una mezcla de plantas autóctonas quemadas para obtener un compuesto jabonoso (REINA y VALERA, 1960; SPITZ, 2010).

Figura 5. Lavado del cabello en las comunidades mexicas.

Figura 6. Raíz de la planta Xiuhamolli. Los habitantes de la América prehispánica tenían la costumbre del baño diario y el lavado frecuente de sus ropas. Para ello utilizaban dos insumos: para lavar la ropa, la raíz de la planta de jabón Xiuhamolli, que contiene saponinas que producen espuma (SAHAGÚN, 1577); y la corteza y fruto del Copalxocotl, para lavar el cuerpo y el cabello (CRUZ, 1552). Aún hoy, el extracto de la corteza se utiliza en el tratamiento de la lepra (ESCOBEDO, 2013). De forma similar, los habitantes de la antigua China producían jabón a base de vegetales y lo utilizaban para la limpieza personal, proceso mejor conocido como “lavado de legumbres”. Posteriormente le adicionaron hierbas y le dieron un uso cosmético (SCHAFER, 1956).
La fórmula egipcia del jabón también fue utilizada por los griegos y los romanos, que lo elaboraban hirviendo grasas y aceites con álcali de ceniza y cal (SPITZ, 2004). Empero, el baño para ellos era una cuestión social y de salud. Para la limpieza corporal usaban, en lugar de jabón, aceite de oliva (ASHENBURG, 2007). Fue hasta el siglo II d.C. que lo comenzaron a utilizar para el baño personal, como resultado de la colonización, que los hizo aceptar su uso y fabricación (SPITZ, 2004). En Europa, el jabón se dejó de utilizar durante siglos para la limpieza personal a causa de algunas creencias que se originaron por la peste negra, recurrente durante la Edad Media. Siglos después, el “jabón de Marsella” (Francia) se generalizó en varias regiones del Mediterráneo, como Savona, Italia, y Castilla, España (SPITZ, 2010). Éste se elaboraba con aceite de olivo y una mezcla de plantas llamada barilla, que proveía el álcali, dado su riqueza en carbonatos de sodio, calcio y potasio, y era abundante en la región. Fue así como, a mediados del siglo XVII, el gobierno de Francia reguló el mercado del jabón de Marsella y propuso reglas para elaborarlo excluyendo las grasas animales.
A lo largo de la historia, distintas civilizaciones utilizaron diversos ingredientes para elaborar el jabón: una sustancia grasa, ya sea de origen vegetal o animal, y un álcali, ya sea cenizas de madera o de plantas, ricas en carbonatos de sodio o potasio. Ese es el origen de la reacción más antigua, la saponificación.
Industrialización del jabón
En 1795, el jabón de Marsella empezó a industrializarse gracias a los trabajos científicos de Nicolas Leblanc en 1787, quien obtuvo el álcali de la sal de mar y el carbón, con calor. En 1783, Scheele descubrió una sustancia dulce a la que llamó ölsus, hoy conocida como “glicerina”, al hervir aceite de olivo con óxido de plomo. Este trabajo condujo al químico francés Eugene Chevreul a explicar la saponificación: después de establecer la estructura del triglicérido afirmó que el jabón es la sal metálica de los tres ácidos grasos (SPITZ, 2010). Estos hallazgos revolucionaron la industria del jabón, que tuvo una gran demanda después de la Segunda Guerra Mundial. Durante este periodo la gente se dio cuenta de la importancia de utilizar jabón, porque salvó la vida de muchos soldados. Por otro lado, la cultura de la higiene propició la reducción de la muerte infantil.La química de la fabricación de los jabones es muy simple. Como sabemos, los jabones son las sales de sodio o potasio de los ácidos grasos, principalmente saturados aunque también insaturados, que contienen cadenas de 10 hasta 18 átomos de carbono. La fuente de estos ácidos grasos es siempre una mezcla natural de los triglicéridos que constituyen las grasas de origen animal o los aceites vegetales (SPITZ, 2010). La mayoría de los fabricantes emplean directamente grasas o aceites. El proceso de fabricación puede ser por neutralización directa de la mezcla de ácidos grasos, o a partir de las grasas o aceites por hidrólisis alcalina, denominada originalmente saponificación (Figura 7).

Figura 7. Ecuación que representa la reacción de neutralización.
Para fabricar jabones por neutralización de los ácidos grasos se requiere de la hidrólisis previa del triglicérido. Un proceso comercial muy exitoso desde principios del siglo XX fue el denominado Twitchell, que consiste en calentar una emulsión de grasas o aceites con 25-30% de agua, catalizando la hidrólisis por calentamiento con vapor durante 24-48 horas en presencia de 0.5 % de ácido sulfúrico y de 1.25 % del catalizador de Twitchell (TWITCHELL, 1906), de transferencia de fase. En este proceso se emplea un reactor abierto.
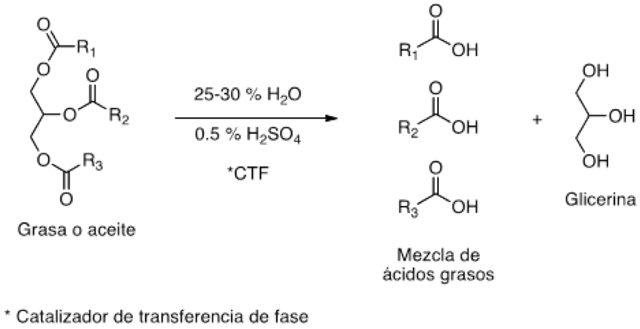
Figura 8. Ecuación que representa la reacción de hidrólisis.
Un proceso de hidrólisis de las grasas o aceites que requiere de tiempos de reacción mucho más cortos que el Twitchell es una reacción a presión que emplea cinc en polvo como catalizador (BRAUN, 1963). También se han diseñado procesos de hidrólisis térmica a 230-240ºC en reactores por lote, semicontinuos y continuos (NANDEV, 1988).
Uno de los métodos más empleados actualmente para fabricar jabones es el denominado “saponificación”, que consiste, como lo ilustramos en la Figura 1, en calentar la grasa o aceite con soluciones concentradas de hidróxido de sodio o potasio, con lo que los ácidos grasos que se producen durante la hidrólisis reaccionan inmediatamente con el álcali para producir directamente la mezcla de las sales de sodio o potasio de los ácidos grasos (TWITCHELL, 1906).
Este jabón, ¿me va a servir?
Como sabemos, no toda el agua contiene las mismas cantidades de electrolitos y minerales. Los jabones no actúan adecuadamente en el agua dura, o bien, ácida. Se conoce como agua dura a la que contiene iones polivalentes como calcio, magnesio o hierro. Es frecuente que el agua de consumo casero contenga estos iones. A pesar de que esta agua, rica en minerales, es potable, los iones y el jabón forman sales insolubles denominadas espuma de agua dura. La siguiente ecuación representa la reacción de un jabón con el ion calcio, elemento abundante en el agua que ha estado en contacto con rocas ricas en minerales de este metal.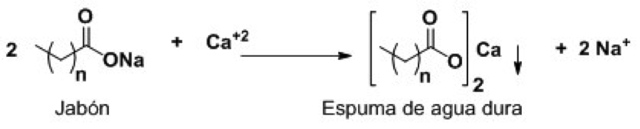
Figura 9. Dos moléculas de jabón intercambian catión para formar una sal de calcio insoluble.
Por otra parte, cuando el jabón entra en contacto con agua ácida, se produce una reacción denominada hidrólisis: el jabón tiende a adquirir nuevamente un hidrógeno y, con ello, proporciona el ácido graso correspondiente, que flota en la superficie en forma de un precipitado graso o espuma ácida.
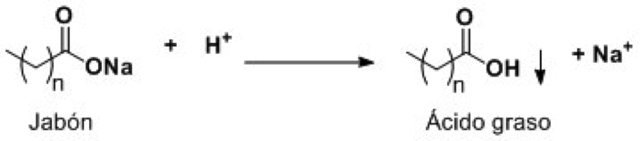
Figura 10. Una molécula de jabón que adquiere nuevamente un hidrógeno y se transforma en el correspondiente ácido graso.
¿Jabones o detergentes?
¿Existe diferencia entre jabón y detergente? El jabón, como sabemos, proviene de la saponificación de una grasa animal o aceite vegetal y un álcali. Como moléculas en general, son carboxilatos de sodio en los jabones duros, o de potasio en los suaves. En cambio, los detergentes son considerados surfactantes sintéticos y pueden ser sales de ácidos sulfónicos, sales cuaternarias de amonio, o surfactantes no iónicos o Zwiteriónicos. Ambos son tensoactivos o surfactantes, ya que en solución tienden a disminuir el ángulo de contacto entre dos fases y con esto afectan la tensión superficial del agua para lograr el efecto de limpieza. Se obtienen mediante diversas reacciones químicas. Por ejemplo, sulfonación, sulfatación, neutralización, cuaternización, alcoxilación, entre otras (STEPAN, 2014).
El jabón líquido se obtiene frecuentemente de la saponificación de aceites o grasas con un alto contenido de ácido oleico y una mezcla proporcional de hidróxido de sodio y de potasio. El resultado es un producto de color oscuro y olor fuerte. Se ha encontrado que utilizando ácidos grasos con una longitud de cadena más grande y ácido sarcosínico, se obtiene un jabón líquido con mejor aroma y color, pero el proceso es muy caro (WILCOX, 2000). Debido a esto, los limpiadores líquidos para manos en el mercado son en realidad surfactantes que los consumidores confunden con jabones líquidos. A esta clase pertenecen también los baños de burbujas, el champú líquido para el cuerpo, y los antibacteriales para manos, entre otros. Las innovaciones en la química de surfactantes pueden ser muchas.

Biodegradabilidad
Una propiedad importante de los jabones, en comparación con los detergentes, es su biodegradabilidad. Durante la Segunda Guerra Mundial, ante la necesidad de obtener jabones solubles en agua de mar, se comenzó la fabricación de detergentes. Al aumentar la demanda, aparecieron detergentes de muy bajo costo elaborados a partir de compuestos de petróleo: los alquilbencensulfanatos (ABS). Tras más de una década de niveles muy altos de venta, empezó a aparecer espuma en aguas residuales y, en algunas regiones, hasta en el agua potable, ya que los microorganismos no degradan con facilidad las moléculas ramificadas del ABS.Los detergentes biodegradables, llamados químicamente alquilsulfonatos lineales (LAS), contienen cadenas lineales de carbono fácilmente descompuestas por los microorganismos que producen enzimas que degradan las cadenas en bloques de dos en dos. En el caso de los detergentes ABS, esta acción enzimática es bloqueada por las ramificaciones (HILL, 2000).
La no biodegradabilidad de los detergentes originó mucha presión en todo el mundo, lo que condujo a discutir este tema y formular legislación que exigiera a los fabricantes de la industria del jabón y detergentes comprobar la biodegradabilidad de sus productos. En México, casi el 100% de la industria de jabones y detergentes elabora detergentes biodegradables utilizando la materia prima adecuada: el dodecil benceno lineal y no el ramificado (INE, 2007).
Aplicaciones tecnológicas
En pleno siglo XXI, las aplicaciones de los surfactantes, tanto jabones como detergentes, son cada vez más abundantes. No sólo se usan en la limpieza del hogar: ahora se utilizan también como biocidas, humectantes, mejoradores de flujo, complementos para la extracción mejorada de petróleo, entre otras aplicaciones (STEPAN, 2014).Conclusiones
El jabón es un compuesto semisintético muy simple, resultado de una reacción química de las grasas o aceites. Ha contribuido no sólo a mejorar la calidad de vida de la especie humana sino a salvar muchas vidas. Asimismo inspiró a los químicos para desarrollar los surfactantes, que tienen innumerables aplicaciones, desde la producción de alimentos hasta la extracción mejorada de petróleo.Bibliografía
ABUD, Leda. El libro de jabones. Buenos Aires: Albatros, 1a. ed. 2004, p. 4-5.
ASHENBURG, Katherine. “The social bath Greeks and Romans”. The Dirt on Clean: An Unsanitized History. USA: Vintage Canada, 2007, p. 13, 32.
BARDINET, Thierry (trad.). Les papyrus médicaux de l'Égypte pharaonique. Paris: Fayard, 1995.
BIBLIA, Jeremías 22:2. Traducción Reina Valera, 1960.
BRAUN, Karl, “Fabricación de jabones”. En Manuales UTEHA. México, 1963.
CLAYDEN Jonathan, Organic Chemistry. Oxford:. Oxford University Press, 1ª ed., 2001.
CRUZ, Martín de la. “An Aztec herbal: the classic codex of 1552”. Traducción y comentarios de William G., introducción de Bruce B. Nueva York: Dover Publications, 2000.
ESCOBEDO, Wendy. Estudio del potencial anti-Helicobacter pylori, gastoprotector y antiinflamatorio de Cyrtocarpa procera, Tesis de Doctorado en Ciencias Biomédicas, Facultad de Medicina, Universidad Nacional Autónoma de México, 2013
GUILLEN, Fedro Carlos. Instituto Nacional de Ecología. Quince años de políticas ambientales en México. México: INE-SEMARNAT, 1a. ed., 2007, p. 83.
HILL, John William, KOLB, Doris K. Química para el nuevo milenio. México: Prentice Hall, 8a. ed., 1999, p. 488.
JONES, Geoffrey. "Cleanliness and Civilization". Beauty Imagined: A History of the Global Beauty Industry. New York: Oxford University Press, 2010, p. 13, 32.
LEVEY, Martín. “Gypsum, Salt and Soda in Ancient Mesopotamian Chemical Technology”. Chicago Journals. 1958, vol. 49, núm. 3, p. 336-342.
NAMDEV, P. D., PATIL, T. A., RAGHUNATHAN, T. S., and SHANKAR, H. S. “Thermal Hydrolysis of Vegetable Oils and Fats 3. An Analysis of Design Alternatives”. Ind. Eng. Chem. Res. 1988, vol. 27, p. 739-743.
SAHAGÚN, Bernardino de, Historia general de las cosas de Nueva España por el fray Bernardino de Sahagún: el Códice Florentino, 1577. [En línea] http://www.wdl.org/es/item/10096/#q=c%C3%B3dice+florentino&qla=es, [Consulta: Abril de 2014]
SCHAFER, Edward H. “The Development of Bathing Customs in Ancient and Medieval China and the History of the Floriate Clear Palace”. Journal of the American Oriental Society. 1956, vol. 76, núm. 2, p. 57-82.
SPITZ, Luis. Soaps Manufacturing Technology. Highland Park, Illinois: AOCS Press, 2010, p. 13-33, 307-311.
-----“The history soaps and detergents”. Sodeopec: Soaps, detergents, oleochemicals and personal care products. Champaign: AOCS Press, 2004, p. 1-2.
STEPAN, [En línea]: www.stepan.com/Why-Stepan/Manufacturing-Strenghts.aspx [Consulta: 29 de abril de 2014].
TWITCHELL, E. “A reagent in the chemistry of fats”. J. Am. Chem. Soc. 1906, vol. 28, p. 196.
WADE, Leroy, Química orgánica, Madrid: Pearson educación, 2004, p. 1162-1168.
WILCOX, Michael, “Soap”. Poucher’s Perfums, Cosmetics and Soaps. 10 ed. Gran Bretaña: Kluwer Academic Publishers, 2000, p. 453-465.
COMENTARIOS
Dirección General de Cómputo y de Tecnologías de Información y Comunicación















